2 中国热带农业科学院热带生物技术研究所, 海口, 571101
 作者
作者  通讯作者
通讯作者
计算分子生物学, 2012 年, 第 1 卷, 第 1 篇 doi: 10.5376/cmb.cn.2012.01.0001
收稿日期: 2012年03月12日 接受日期: 2012年05月18日 发表日期: 2012年05月25日
引用格式(中文):
姚晶等, 2012, 植物甜蛋白马宾灵(MabinlinⅡ)的二级结构及其B细胞抗原表位预测, 计算分子生物(online) Vol.1 No.1 pp.1-6 (doi: 10.5376/cmb.cn. 2012.01.0001)
引用格式(英文):
Yao et al., 2012, Prediction of the Secondary Structure and B Cell Epitopes of the Plant Sweet Protein MabinlinⅡ, Jisuan Fenzi Shengwu (online) (Computational Molecular Biology) Vol.1 No.1 pp.1-6 (doi: 10.5376/cmb.cn.2012.01.0001)
马宾灵(MabinlinⅡ)是中国所特有的植物甜蛋白,在目前已知的七种植物甜蛋白中具有最佳的热稳定性,将其作为新型甜味剂有着广阔的市场前景。本研究以马宾灵的氨基酸序列为基础,采用Garnier-Robson方法和Chou-Fasman方法预测马宾灵的二级结构,采用Karplus-Schulz方法预测马宾灵的蛋白质骨架区柔韧性,采用Kyte-Doolittle方法预测马宾灵的蛋白质疏水性,采用Emini方法预测马宾灵的蛋白质表面可能性,采用Jameson-Wolf方法预测马宾灵的B细胞抗原表位。分析结果表明,马宾灵的A链多形成转角和无规则卷曲结构,A链的N端27~30区段形成较柔软的蛋白质骨架结构,A链的N端4~6、7~9、10~11、12~14、20~22、23~26和30~33区段为抗原位点的可能性较大;马宾灵的B链多形成β折叠和转角结构,B链的N端0~7、9~13、28~29、33~34、40~45、53~54和55~57区段为抗原位点的可能性较大。本研究以生物信息学手段分析预测马宾灵的二级结构及其B细胞抗原表位,为设计马宾灵多克隆抗体以检测马宾灵在不同生物反应器中的表达研究提供参考数据。
植物甜蛋白是指自然界中存在的具有甜味或可以引起甜味产生的蛋白质,它们通常来源于热带植物的果实或种子(施建科, 1998, 化学通报, 8: 22-26)。目前,世界上已发现的植物甜味蛋白有7种,其中植物甜蛋白马宾灵(MabinlinⅡ)是马槟榔种子中的贮藏蛋白。马槟榔是我国特有的、仅分布于我国热带、亚热带地区的珍稀濒危野生果树资源(胡新文等, 1998)。马宾灵在马槟榔种子中有4种同系物蛋白,其中仅MabinlinⅡ具有最佳耐酸性和热稳定性因而也研究的最为深入。马宾灵(MabinlinⅡ)具有高甜度,无毒、非热源性等特点,将其作为新型食品甜味剂的应用广泛(范长胜, 2001)。
由于野生的马槟榔资源极其有限且在不断的萎缩,以基因工程的手段开发应用马宾灵(MabinlinⅡ)的研究遂成为研究的热点。在2001年,刘敬梅等(2001)人将马宾灵基因转入莴苣中表达;2004年,李晓东等(2004)人将马宾灵基因转入番茄中表达;2009年,顾文亮等(2009a; 2009b)人将重组马宾灵基因转入拟南芥与大肠杆菌中表达;2011年,张菲菲等(2011)人构建了含重组马宾灵基因的植物表达载体,拟转入人参果中表达。随着技术手段的不断进步,将马宾灵及其重组基因导入多中生物反应器中表达已经成为可能,因而制备专一和灵敏马宾灵多克隆抗体用于马宾灵基因工程产物的检测显得尤为必要。
本研究以马宾灵(MabinlinⅡ)的氨基酸序列为基础,分别对马宾灵的A链与B链进行蛋白质的二级结构、骨架区柔韧性、亲水性、表面可能性和B细胞抗原表位预测,经综合分析后得到马宾灵A链与B链的可能抗原决定位点,为人工制备特异性的马宾灵多克隆抗体提供一定的参考数据。
1结果与分析
1.1马宾灵(MabinlinⅡ)的氨基酸序列
成熟的马宾灵(MabinlinⅡ)蛋白为A链与B链通过链内与链间二硫键结合的二聚体蛋白结构。马宾灵前体蛋白的信号肽、N-端肽、连接肽以及C-端肽均在体内翻译后加工过程中被剪接掉,有甜味活性的马宾灵蛋白是由A链含33个氨基酸残基与B链含72个氨基酸残基(图1)通过非共价作用紧密结合在一起的。
图1马宾灵(MabinlinⅡ)的氨基酸序列 Figure 1 Amino acid sequence of MabinlinⅡ |
1.2马宾灵(MabinlinⅡ)的二级结构预测
采用Garnier-Robson方法进行马宾灵(MabinlinⅡ)的二级结构预测,经分析发现其A链没有形成α–螺旋结构,而在N-端的20~22区段形成β-折叠结构(图2);其B链没有形成α–螺旋结构,而在N-端的7~10、12~15、18~19、21~40、42~51、57~62、65~70多个区段形成β-折叠结构(图2)。
|
|
采用Chou-Fasman方法进行马宾灵(MabinlinⅡ)的二级结构预测,经分析发现其A链在N-端的0~27区段形成α-螺旋结构但没有形成β-折叠结构(图3);其B链(图3)在N-端的24~40和44~54区段形成α-螺旋结构,在N-端的13~27以及29~40区段形成β-折叠结构。
 图3按Chou-Fasman方法预测的马宾灵(MabinlinⅡ)A链及B链的二级结构 Figure 3 Secondary structure of MabinlinⅡA-chain and B-chain predicted with Chou-Fasman method |
综合Garnier-Robson方法和Chou-Fasman方法的预测结果显示,马宾灵(MabinlinⅡ)的A链形成α–螺旋结构和β-折叠结构的可能性较小;马宾灵(MabinlinⅡ)的B链形成α–螺旋结构的可能性较小,而在其N-端的12~15、18~19、21~27及29~40多个区段形成β-折叠结构的可能性较大。
1.3马宾灵(MabinlinⅡ)的可能抗原位点预测
1.3.1马宾灵(MabinlinⅡ)的骨架区柔韧性预测
采用Karplus-Schulz方法进行马宾灵(MabinlinⅡ)的蛋白质骨架区柔韧性预测,经分析发现其A链N-端的27~30区段(图4)和其B链N-端的0~7、10~12、15~18、40~42、52~54和55~57区段(图4)形成蛋白骨架柔韧性区域的可能性较大。
图4 按Karplus-Schulz方法预测的马宾灵(MabinlinⅡ) A链及B链的柔韧性区域 Figure 4 The flexible region of MabinlinⅡA-chain and B-chain predicted with Karplus-Schulz method |
1.3.2马宾灵(MabinlinⅡ)的亲水性预测
采用Kyte-Doolittle方法进行马宾灵(MabinlinⅡ)的亲水性预测,经分析发现在其A链N-端的0~17和19~33区段形成两个所跨区段较大的亲水性区域结构(图5);在其B链的N-端的0~19、27~28、30~34、37~51、52~54和55~57区段形成多个亲水性区域结构(图5)。
.png) 图5按Kyte-Doolittle方法预测的马宾灵(MabinlinⅡ)A链及B链的亲水性分析 Figure 5 The hydrophilic analysis of MabinlinⅡA-chain and B-chain predicted with Kyte-Doolittle method |
1.3.3马宾灵(MabinlinⅡ)的表面可能性预测
采用Emini方法进行马宾灵(MabinlinⅡ)的蛋白质表面可能性预测,经分析发现在其A链的N-端4~6、7~9、10~14、20~22、23~26和30~33区段位于蛋白质表面的可能性较大(图6);在其B链的N-端0~6、14~18、28~30、32~34、41~45和54~55区段位于蛋白质表面的可能性较大(图6)。
 图6按Emini方法预测的马宾灵(MabinlinⅡ)A链及B链的表面可能性区域 Figure 6 The possibility of surface area of MabinlinⅡA-chain and B-chain predicted with Emini method |
1.3.4马宾灵(MabinlinⅡ)的B细胞抗原表位预测
采用Jamesorr Wolf方法进行马宾灵(MabinlinⅡ)的B细胞抗原表位预测,经分析发现在其A链的N-端0~11、12~19和20~33区段为抗原指数较高的区段(图7);在其B链的N-端0~7、9~21、28~29、33~34、40~57、62~63和66~68区段为抗原指数较高的区段(图7)。
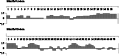 图7按Jamesorr Wolf方法预测的马宾灵(MabinlinⅡ) A链及B链的抗原指数 Figure 7 The antigen index of MabinlinⅡprotein A-chain and B-chain predicted with Jamesorr Wolf method |
综合Karplus-Schulz方法的蛋白质骨架区柔韧性预测、Kyte-Doolittle方法的蛋白质亲水性预测、Emini方法的蛋白质表面可能性预测和Jameson-Wolf方法的B细胞抗原表位预测,经分析发现马宾灵(MabinlinⅡ) A链的N-端4~6、7~9、10~11、12~14、20~22、23~26和30~33区段为抗原位点的可能性较大;马宾灵(MabinlinⅡ)B链的N-端0~7、9~13、28~29、33~34、40~45、53~54和55~57区段为抗原位点的可能性较大。
2讨论
随着生物信息学技术的不断发展,应用生物信息学对蛋白质的结构与功能进行分析预测的方法已经日益完善。蛋白质的二级结构是影响蛋白质的抗原表位的主要因素之一,相比于α-螺旋与β-折叠等二级结构的较高化学键键能下所维持的较牢固的蛋白质高级结构,蛋白质的转角及无规则卷曲等二级结构通常比较松散,易于发生扭曲或盘绕并展示在蛋白质的表面,因此在该氨基酸残基区域通常含有优势的蛋白质抗原表位。另一方面,由于在多肽折叠为成熟的蛋白质的过程中通常会发生构象变化,某些具有较高抗原指数的区段会被外层的氨基酸残基或糖基所屏蔽,故在采用Jameson-Wolf方法预测蛋白质的抗原指数时,抗原指数较高的区段并不一定就是优势抗原表位区域。根据本研究的分析预测结果,马宾灵A链的近C-端和中间区段多形成较多的无规则卷曲结构,同时该区段的抗原指数较高且其亲水性指数和蛋白表面可能性也比较大,故该区段为优势抗原表位的可能性较大;虽然A链的其它一些区段如0~1、4~6、7~9和10~11区段的抗原指数也较高,但是其亲水性和蛋白质表面可能性指数偏低,综合分析这些区段作为抗原表位的可能性不大。马宾灵B链的N-端和中间区段的抗原指数较高,且亲水性指数和蛋白质蛋白表面可能性也较大,故该区段为优势抗原表位的可能性较大。
3材料与方法
3.1马宾灵(MabinlinⅡ)的氨基酸序列
马宾灵(MabinlinⅡ)的A链与B链的氨基酸序列分别通过GeneBank序列编号为D83997.1的马宾灵(MabinlinⅡ) mRNA序列推导,其A链含有33个氨基酸残基,其B链含有72个氨基酸残基。
3.2马宾灵(MabinlinⅡ)的二级结构的预测
应用DNA Star Protean软件提供的模块分别对马宾灵(MabinlinⅡ)的A链和B链的氨基酸序列进行分析,采用Garnier-Robson方法和Chou-Fasman方法预测马宾灵(MabinlinⅡ)的二级结构。
3.3马宾灵(MabinlinⅡ)的可能抗原位点的预测
应用DNA Star Protean软件提供的模块分别对马宾灵(MabinlinⅡ)的A链和B链进行可能抗原位点分析,采用Karplus-Schulz方法预测马宾灵(MabinlinⅡ)的蛋白质骨架区柔韧性,采用Kyte-Doolittle方法预测马宾灵(MabinlinⅡ)的蛋白质疏水性,采用Emini方法预测马宾灵(MabinlinⅡ)的蛋白质表面可能性,采用Jameson-Wolf方法预测马宾灵(MabinlinⅡ)的B细胞抗原表位,最后综合分析马宾灵(MabinlinⅡ)的可能抗原位点。
作者贡献
姚晶负责该论文的设计、操作及文章的撰写;顾文亮和夏启玉协助实验设计及数据分析;胡新文老师负责实验指导;郭建春老师是本论文的通讯作者,负责整个论文数据分析及文章撰写的整个过程。
致谢
本研究由国家自然科学基金(31060123)和2010年海南省研究生创新科研课题资助。
参考文献
Fan C.S., 2001, Research on development and application of sweet-tasting proteins, Shipin Yu Fajiao Gongye (Food and Fermentation Industries), (12): 50-54 (范长胜, 2001, 甜蛋白的开发与应用研究, 食品与发酵工业, (12): 50-54)
Gu W.L., Hu X.W., and Guo J.C., 2009a, Reorganization and structure analysis of MBL II gene, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 45(4): 333-339 (顾文亮, 胡新文, 郭建春, 2009a, 马槟榔甜蛋白基因(MBL II)的剪切重组和结构分析, 植物生理学通讯, 45(4): 333-339)
Gu W.L., Xia Q.Y., Hu X.W., and Guo J.C., 2009b, Expression of recombinant mabinlin 1I in Escherichia coli induced by IPTG, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(3): 439-444 (顾文亮, 夏启玉, 胡新文, 郭建春, 2009b, 重组马槟榔甜蛋白MabinlinII在大肠杆菌中的表达, 基因组学与应用生物学, 28(3): 439-444)
Hu X.W., Guo J.C., and Zheng X.Q., 1998, Cloning and sequencing of cDNA encoding sweet tasting plant protein Mabinlin II, Shengming Kexue Yanjiu (Life Science Research), 2(3): 189-193 (胡新文, 郭建春, 郑学勤, 1998, 植物甜蛋白 Mabinlin II cDNA的克隆与序列分析, 生命科学研究, 2(3): 189-193)
Li X.D., Liu J.M., Chen H., Cheng Z.H., and Chai M., 2004, Gentic transformation of sweet protein MBL 1I on tomato, Xibei Zhiwu Xuebao (Acta Botanica Boreale— Occidentalia Sinica), 24(5): 808-811 (李晓东, 刘敬梅, 陈杭, 程智慧, 柴敏, 2004, 甜蛋白基因MBL I1对番茄的遗传转化, 西北植物学报, 24(5): 808-811)
Liu J.M., Chen D.M., and Chen H., 2001, Genetic transformation and plant regeneration of lettuce with sweet protein gene MBL II, Yuanyi Xuebao (Acta Horticulturae Sinica), (3): 246-250 (刘敬梅, 陈大明, 陈杭, 2001, 甜蛋白基因MBL II对莴苣的遗传转化, 园艺学报, (3): 246-250)
Zhang F.F., Peng Z.Y., and Zhang J.W., 2011, Recombination of MBL gene and the construction of plant fruit-specific expressed vector, Gansu Nongye Daxue Xuebao (Journal of Gansu Agricultural University), (1): 49-54, 62(张菲菲, 彭治云, 张金文, 2011, 马槟榔MBLII基因重组及果实特异表达载体构建, 甘肃农业大学学报, (1): 49-54, 62)
